Por: Rodrigo Fernando de Almeida Caselgrandi, graduando em Ciências Biológicas e Dr. Elisandro Ricardo Drechsler-Santos – Departamento de Botânica da Universidade Federal de Santa Catarina (UFSC).
drechslersantos@yahoo.com.br
Você já assistiu ao filme Avatar? Neste e em outros filmes de ficção científica, florestas inteiras são retratadas como organismos inteligentes, conectados por uma rede (Figura 1), muitas vezes subterrânea e invisível. Parece pura imaginação, mas a realidade não está tão distante assim. Sob nossos pés, fungos constroem verdadeiras teias vivas (veja mais AQUI), redes que lembram cabos de internet natural, capazes de ligar diferentes pontos da floresta.

Se isso ainda soa exagerado, pense em algo mais próximo: aplicativos como o Google Maps, que sugerem rotas mais rápidas e menos trabalhosas. Agora imagine um organismo sem cérebro, sem olhos e sem nervos, mas que consegue otimizar caminhos de maneira tão eficiente quanto um desses algoritmos.
E, para aproximar ainda mais, pense nas suas próprias decisões. Quantas vezes você escolhe algo quase de forma automática, como ir por um caminho conhecido, seguir um hábito, e isso acontece de forma meio que automática, sem refletir demais, mas ainda assim de modo funcional? A natureza também faz isso. E não são apenas animais ou plantas: fungos também parecem tomar decisões.
Foi exatamente essa a descoberta de pesquisadores da Universidade de Tohoku, no Japão. Em um estudo recente, os cientistas descobriram que o fungo Phanerochaete velutina (Figura 2a), famoso por decompor madeira em florestas temperadas, não cresce ao acaso. Pelo contrário, ele ajusta sua rede de hifas – tipo celular filamentoso único que molda o corpo dos fungos (Figura 2b), de acordo com a forma como seus recursos estão distribuídos, como se “reconhecesse” padrões espaciais.


O experimento foi engenhoso em sua simplicidade. Cientistas arranjaram blocos de madeira colonizados pelo fungo em duas figuras: um círculo e uma cruz (figura 3). Ao longo de meses, observaram como o micélio (conjunto de hifas) crescia entre os blocos e mediram a intensidade da decomposição da madeira.
O que viram foi surpreendente. No arranjo em cruz, o fungo reforçou as conexões nas extremidades, como se priorizasse as pontas da figura. Já no círculo, a rede ficou mais equilibrada, mas o centro permaneceu quase vazio, sinal de que o fungo não desperdiçou energia preenchendo uma área sem blocos de madeira. Em ambos os casos, os blocos com mais conexões foram também os que mais perderam massa. Isso mostra que a arquitetura do micélio não é só estética: ela afeta diretamente a eficiência do trabalho ecológico que o fungo desempenha.
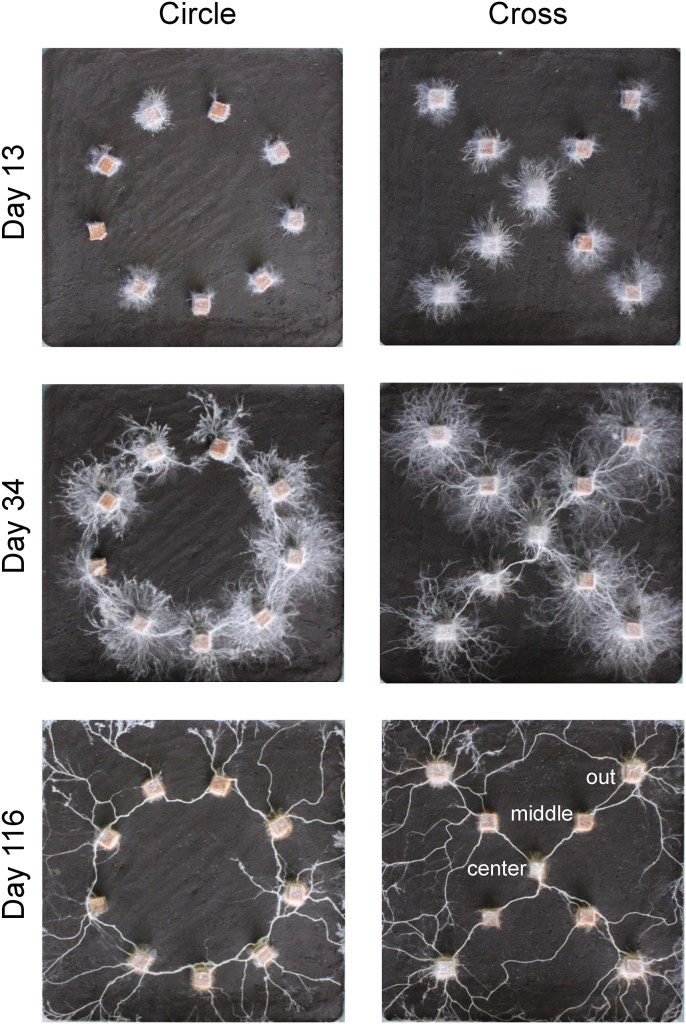
Traduzindo: o crescimento não foi aleatório. O micélio escolheu caminhos, otimizou conexões e adaptou sua forma à geometria do ambiente. Para os pesquisadores, trata-se de um tipo de “reconhecimento de padrões” — não no sentido de consciência ou pensamento humano, mas como uma estratégia biológica eficaz. Uma inteligência distribuída, descentralizada, que emerge da rede de hifas e de suas interações.
Essa descoberta tem várias camadas de importância. Primeiro, revela que organismos simples podem apresentar comportamentos sofisticados. Se falamos em decisões, logo pensamos em cérebros, neurônios e sistemas nervosos. Mas a vida encontra soluções complexas por outros caminhos — e os fungos são mestres nisso.
Segundo, há implicações ecológicas profundas. Fungos como o P. velutina são protagonistas invisíveis na ciclagem de nutrientes, na decomposição da madeira e no balanço global de carbono. Entender como eles exploram recursos ajuda a prever como os ecossistemas respondem a mudanças ambientais. E, em tempos de crise climática, todo detalhe do ciclo de carbono importa.
Terceiro, há ainda as inspirações tecnológicas. Redes miceliais já serviram de modelo para algoritmos computacionais e para pensar novas formas de organização descentralizada. A forma como esses organismos otimizam energia e caminhos pode inspirar soluções em logística, ciência de dados e até urbanismo.
E, por fim, a dimensão filosófica. Estudos como esse nos convidam a repensar a ideia de inteligência. Talvez seja hora de aceitar que inteligência não é um monopólio dos animais com cérebros. Ela pode emergir de redes, de interações, de estratégias de vida distribuídas. O micélio não pensa como nós, mas age de modo eficiente e estratégico, lembrando que a natureza sempre encontra maneiras criativas de resolver problemas. Não sejamos um problema para ela, então!
Da próxima vez que você encontrar um cogumelo na floresta, lembre-se: aquilo é só a ponta visível de uma rede subterrânea vasta, silenciosa e engenhosa. Uma rede capaz de reconhecer formas, otimizar caminhos e sustentar o equilíbrio da vida. O que parecia ficção científica talvez seja apenas um retrato, ainda parcial, da inteligência discreta dos fungos.
Para saber mais:








